
Polymerase-Ketten-Reaktion (PCR)
Die Polymerase-Ketten-Reaktion (PCR) ist ein Verfahren zur zyklischen Ampflifikation von DNA-Abschnitten mit Hilfe flankierender Primer unter Verwendung einer hitzestabilen Polymerase. Die PCR ist eine Grundtechnik in der Molekularpathologie. Neben der klassischen Endpunkt-PCR werden in unserer Routinediagnostik noch Real-time PCR und Droplet Digital PCR durchgeführt.
Die Real-time PCR beruht auf dem herkömmlichen PCR-Prinzip, allerdings erlaubt die Verwendung Fluoreszenz-markierter Primerr bzw. Sonden eine Quantifizierung der gewonnenen DNA in jedem Synthesezyklus. Dabei nimmt die Fluoreszenz proportional zur Menge des PCR-Produkts zu. Die Real-time PCR ist äußerst spezifisch und sensitiver als die klassische Endpunkt-PCR.
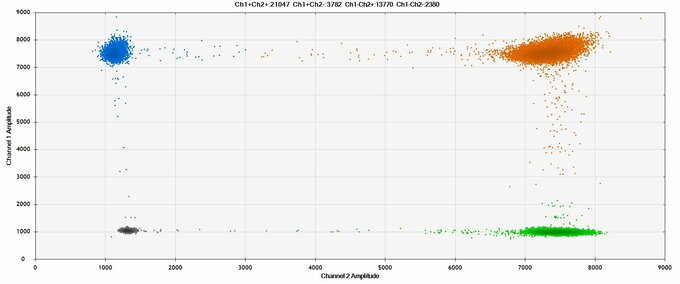
Das Prinzip der Droplet Digital PCR (ddPCR) beruht in der Aufteilung des Gesamtreaktionsansatzes in viele kleine Einzelreaktionen (Partitionen), im Falle der ddPCR in Wasser-in-Öl-Tröpfchen (Droplets). Die Targetamplifikation erfolgt dann parallel in jedem einzelnen Tropfen, wobei verschiedene mit Farbstoff markierte Sonden- (z.B. TaqMan®, HDR, NHEJ) oder Evagreen-Assays eingesetzt werden können. Anschließend werden die PCR-Signale (Target-positiv, Target-negativ) der einzelnen Droplets mit Hilfe eines Fluoreszenz-Readers ausgelesen und über eine Software ausgewertet. Da der Anteil positiver Droplets mit der eingesetzten DNA-Menge der amplifizierten Target-Region korreliert, kann eine genaue Quantifizierung erfolgen. Durch die Partitionierung in Einzelreaktionen steigt die Sensitivität der PCR-Methode deutlich an (Nachweisgrenze < 0,1%). Die ddPCR stellt eine ideale Technik für den sensitiven Nachweis und die präzise Quantifizierung von niederfrequenten Krebsmutationen (Diagnose, Therapiemonitoring, frühe Rezidiverkennung) und pathogenen Erregern dar.




